越谷市立病院 診療部 滅菌管理室 主査 酒井大志先生、東京大学医学系研究科侵襲代謝・手術医学講座教授/同 医学部附属病院 手術部 教授・手術部長・材料管理部長・病態栄養治療センター長 深柄和彦先生に「感染のリスクは大丈夫?知っておきたい再製造単回使用医療機器(R-SUD)の基礎」についてご執筆いただきましたので、掲載いたします。
(本誌のご購入はこちらから)
【サマリー】
日本では、2017年より使用済み単回使用医療機器を回収し、専門事業者が適切に分解、洗浄、部品交換、再組み立て、滅菌などの処理を行い、必要な性能などを有することを確認して、再び使用できるようにする「再製造単回使用医療機器」の制度が運用されている。2024年度の診療報酬改定において、再製造単回使用医療機器の使用に対する評価が新設され「再製造単回使用医療機器使用加算」が新規収載されたとともに、施設基準も記載されたことから、さらなる普及が期待されている。本稿では、その記載内容と解説、再製造単回使用医療機器(R-SUD)と単回使用医療機器(SUD)との違いについて述べたい。
キーワード:アデノウイルス、感染症発生動向調査、原因不明の急性肝炎
単回使用医療機器(Single-use device, SUD)とは
医療機器は添付文書により、再使用可能な医療機器か、一回の使用で破棄する単回使用医療機器かが必ず明示されている。このうち単回使用医療機器(以下SUD)は、使い捨てを前提に設計開発されているため、医療現場で適切に洗浄、滅菌などが行えるようにデザインはされていないことから「一回限りの使用で廃棄する」と添付文書に記載、警告されている[1]。これらのことから厚生労働省は、感染の防止を含む医療安全の確保のため、添付文書で指定された使用方法などを遵守すること、院内で洗浄・滅菌して再利用することの危険性を、2001年から全国の医療機関に幾度となく通知し禁じている。
院内でSUDの洗浄・滅菌を行い、繰り返し使用している施設はありませんか?
厚生労働省で厳しく指導されているのは機能の問題と感染の恐れがあるから
SUD を院内で洗浄・滅菌して再利用することは、洗浄・滅菌不良や耐熱性・耐久性・耐腐食性・耐薬品性などの不足による劣化や剝離欠損、予期せぬ不具合が懸念されることから、医療機器としての機能や安全性を製造企業が担保しないものとなるだけでなく、患者の不利益、医療事故につながる可能性を孕んでいる。いくつかの事例を、日本医療機能評価機構の「医療事故情報収集等事業 事例検索」から紹介する表1 。

表1 のように、厚生労働省からの再使用禁止通知がされた後にも、使用後に捨てなければならないSUDを、別の患者に内緒で使い回すという不適切使用が一部医療施設において繰り返されていた。
「SUD は高額なので繰り返し自施設で再生処理をして使いたい」という不適正使用問題の解決、単回使用による医療費の増加を抑制し医療廃棄物を減少する効果が期待され、R-SUDに関する法整備と安全性を確保するための基準策定が進められた。
再製造単回使用医療機器(R-SUD)は、医療施設で使用されたSUDを、新たに製造販売をすることを目的として、医療施設から回収し、検査、分解、洗浄、滅菌、その他部品の交換を含め必要な処理を施し、原型医療機器と同等の製品として製造販売される医療機器のことをいう。
R-SUDは、オリジナル品を再生部品として使用し、再製造された「新品」の医療機器である。院内で洗浄・滅菌して再利用することとの大きな違いは、原型医療機器と同等の機能と安全性が保障され、その責任は製造販売企業がもつ点である。
保険医療材料制度においては、償還価格について原型医療機器の7割程度を原則としている。特定保険医療材料のうち3つの機能区分が保険適用されており、「K595経皮的カテーテル心筋焼灼術」を実施する際に使用されているが、算定回数は原型医療機器と比較して限定的である。
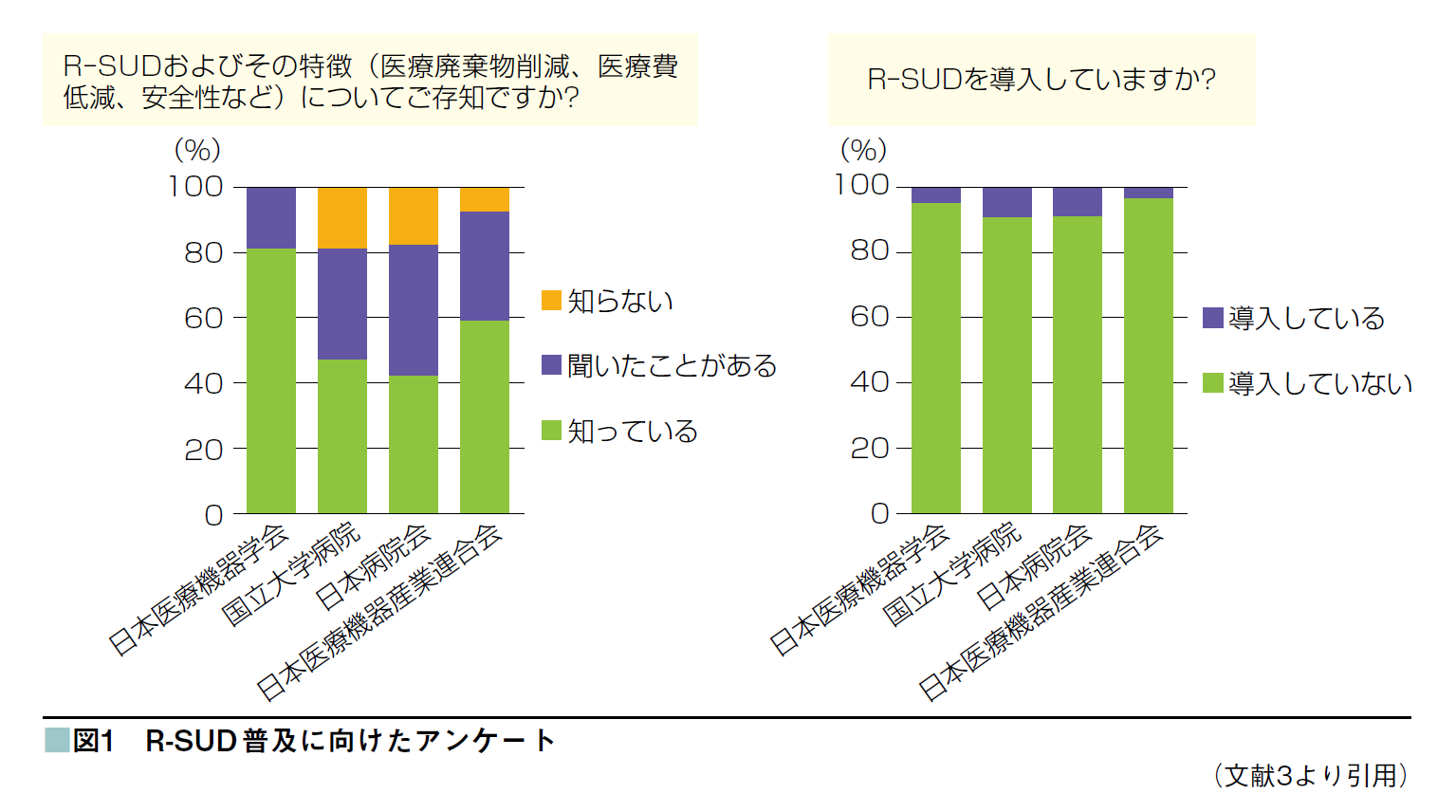
2022年度に実施した医療施設へのアンケート(回答数306)[2]では、「R-SUD を知っている・聞いたことがある」が83%であるのに対し、導入している施設が8.2%と認知はされているが導入率が低い現状であった図1 [3]。特に、償還品使用の際には医療機関において患者に別途説明が必要であることのほかに、研修の受講や回収の手間などの医療機関側の人的コストに対して、得られるインセンティブが少ないことなどが、普及が進まない要因となっていた。
日本では、R-SUDの制度がはじまり7年になるが(2024年5月時点)、医療現場で普及したとは言えない状況である。安全性や感染リスクについて疑問に感じる方もいらっしゃるかもしれない。結論から言うと、再製造単回使用医療機器基準やR-SUD製造企業向けガイドラインなども整備され、R-SUDは原型医療機器と同等の機能と安全性が科学的根拠をもって保障されていることから、心配には至らないと考える。
再製造に使用できる再生部品は、再製造単回使用医療機器基準に記載があり、収集したSUDを、部品のレベルまで分解した後に除染を行い清浄度を確保する、R-SUD製造企業向け洗浄ガイドラインが策定されている表2 [4]。

また、医療機関と収集した年月日、シリアル番号や再製造された回数、再生部品・検査・製造工程から流通に至るまでの品質、製造管理、トレーサビリティの確保ができていることや、さらには医療施設側での取り扱い指導などの実施も義務付けられるなど、R-SUDの品質・製造管理などについて厳しい基準が設けられている。そして、PMDA(医薬品医療機器総合機構)から厳密な審査・調査・承認を受けたものが製造販売されている。
さらに、R-SUDは全数検査が実施されることから、不具合発生率が抑制されることもメリットの一つであるといわれている。
これらのことから、R-SUDの国内における不具合などの報告はないと、「令和5年度 再製造SUD推進検討委員会報告書」に記載されている3)。また、すでにR-SUDの普及が進んでいる米国においては、2008年の米国政府監査院GAOによる安全性に関する調査報告で、数百万にのぼる使用済み単回使用医療機器が再製造されたが、再製造品に起因する感染率上昇を示す事実はないとしている[5]。
2024年度診療報酬改定により「R-SUD(特定保険医療材料に限る)を手術に使用した場合に、当該特定保険医療材料の所定点数100分の10に相当する点数を当該手術の所定点数に加算する」との内容が新設されたとともに、表3 [6]の3つの項目の施設基準が記載された。

このうち、懸念事項であった②の患者説明の方法に関しては、R-SUDの制度、原型医療機器との違い、手術に使用した場合の影響などの説明を含めた説明文書を交付するとともに、手術説明文書のなかに「再製造単回使用医療機器を使用することがある」と記載し説明するとされた[7]。
③の回収などの実施については、原型医療機器を使用している医療機関では、回収を適切に実施していることが必須となるが、原型医療機器を使用していない医療機関であっても、今後、使用する際には適切に回収を実施する意思があるのであれば、基準を満たしていると判断してよいとされている。
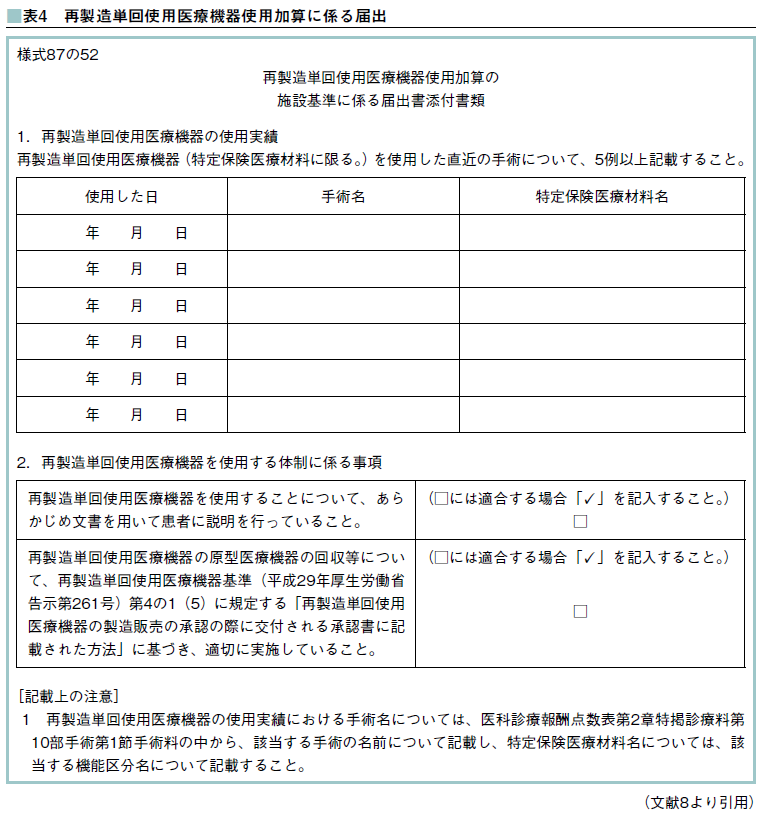
再製造単回使用医療機器使用加算に係る届出については、表4 [8]のように「様式87の52」の書類提出が求められる[9]。
おわりに
2017年よりR-SUD 制度の運用がスタートした。R-SUDの普及は、患者の安全と増え続ける医療費や医療廃棄物の削減、昨今露呈したコロナ禍・ウクライナ問題などの世界情勢による医療機器不足、特に資源不足の日本において、有意義である。
2024年度診療報酬改定により、R-SUDの使用加算が記載された。現時点では、参入企業と品目数も多くはないが、今後、諸外国と同様に拡がっていくことが期待されている。
現在の医療保険システムのもと、今後も日本においてハイレベルの医療をすべての国民に提供するためには、コストの概念を、病院も医療機器を製造販売する企業も深く考えなくてはいけない時代になっている[10]。SUDの不適切再使用は感染対策上深刻な問題を引き起こす一方で、R-SUDについては感染対策上も問題がないことを知っていただき、その普及に興味をもっていただけたら幸いである。
【引用・参考文献】
1) 酒井大志.私たちは何のために業務改善を行うのか?.首都圏滅菌管理研究会誌.6(1),2023,86p.
2) 深柄和彦.令和4年度 厚生労働省 再製造SUD基準策定等事業 再製造SUD 推進検討委員会報告書.https://dmd.nihs.go.jp/rsud_public/R4report.pdf
3) 山本栄一.再製造単回使用医療機器の推進と今後の展望 令和5年度 厚生労働省再製造SUD基準策省定事業再製造SUD推進検討委員会報告書 別添4.https://dmd.nihs.go.jp/rsud_public/R5report.pdf
4) 厚生労働省.事務連絡 再製造単回使用医療機器に係る事業者向け洗浄ガイドライン及び質疑応答集(Q&A)について.https://www.mhlw.go.jp/web/t_doc?dataId=00tc7535&dataType=1&pageNo=1
5) 佐伯広幸.米国の医療現場における単回使用医療機器(SUD)再製造の実態.医療機器学.88(6),53.
6) 厚生労働省.令和6年度診療報酬改定について.https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000188411_00045.html
7) 厚生労働省.特掲診療料の施設基準等及びその届出に関する手続きの取扱いについて.https://kouseikyoku.mhlw.go.jp/kyushu/000306324.pdf
8) 地方厚生局.再製造単回使用医療機器使用加算の施設基準に係る届出書添付書類.https://kouseikyoku.mhlw.go.jp/shikoku/r6-t87-52.pdf
9) 厚生労働省.事務連絡 疑義解釈資料の送付について(その1).https://www.mhlw.go.jp/content/12404000/001237675.pdf
10) 深柄和彦.解説 単回使用器材.首都滅菌管理研究会誌.2(2),2018,4p.

(本誌のご購入はこちらから)
*INFECTION CONTROL33巻8月号の掲載の先行公開記事となります。
*本記事の無断引用・転載を禁じます。





